DIAGRAMA DE MOELLER
En el átomo existen también subniveles:
|

particulas subatomicas
Puede ser una partícula elemental o una compuesta, a su vez, por otras partículas subatómicas, como son los quarks, que componen los protones y neutrones. No obstante, existen otras partículas subatómicas, tanto compuestas como elementales, que no son parte del átomo, como es el caso de los neutrinos y bosones.

principios de aufbau
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía


SUBNIVELES ENERGÉTICOS
Los subniveles energéticos se designan como s, p,d, y f estas letras son tomadas de las palabras empleadas para dar nombres a las lineas de los series espectrales del hidrógeno así: s de sharp, p de principal, d de difude y f de fundamental. Cada uno de los corresponde a las diferentes valores de l y puede contener un numero determinado de electrones. Por ejemplo cuando 1=0, le corresponde el subniveles s, que puede contener un máximo de electrones si l=1 le corresponde el subnivel p, que puede contener máximo de 6 electrones.
Se indicara el subnivel que corresponde a cada valor de l, así como el numero máximo de electrones que soporta:
Valore del numero cuántico secundario l
|
Tipo de subniveles
|
Numero máximo de electrones
|
0
|
s
|
2
|
1
|
p
|
6
|
2
|
d
|
10
|
3
|
f
|
14
|
Para tener una idea muy aproximada de la distribución de los electrones en los diferentes niveles y subniveles se utiliza el diagrama de Möller. Este diagrama indica el orden de llenado de los subniveles y niveles de energía de un átomo, de arriba hacia abajo, siguiendo el sentido de las flechas, hasta llegar al número de electrones que tiene dicho átomo.
Ejemplo. Escribe la estructura electrónica (distribución de electrones en la corteza) del elemento Ho (Z = 67).
El número de protones coincide con el número atómico, es decir tendrá 67 protones. En el átomo neutro habrá tantos protones como electrones: nº e- = 67. Dibujando el diagrama de Möller, se van cubriendo los huecos hasta alcanzar el número de 67 electrones.
Principio de Exclusión de Pauli.
Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero (fermiones).
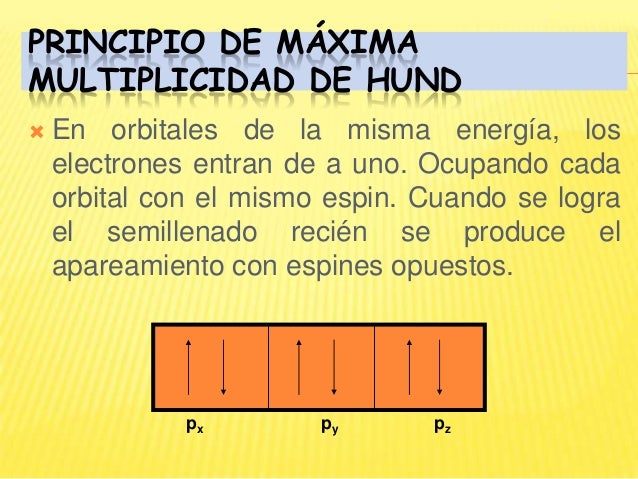
Principio de máxima multiplicidad de Hund
Este principio fue enunciado en 1927 por Hund, y establece lo siguiente:
Los electrones, al ocupar en un átomo orbitales de igual energía, lo hacen con el mayor número posible de electrones desapareados, con spines paralelos.
Los orbitales de igual energía se denominan orbitales degenerados; así, los orbitales p, que son tres, son triplemente degenerados, ya que los tres tienen igual energía y sólo cambia la orientación; los orbitales dson cinco, y por ello, quíntuplemente degenerados.
Por ejemplo, el átomo de nitrógeno, que tiene siete electrones, ha de colocar tres de ellos en orbitales p de igual número cuántico principal, y tiene dos posibilidades de hacerlo: puede formar una pareja en un orbitalp ( px py o pz ), y ei tercer electrón situarse en otro orbital p, quedando uno vacío,
o bien colocarse un electrón en cada uno de los orbitales,
La segunda representación es la más estable, ya que en el primer caso habría de vencerse la repulsión de los dos electrones situados en el mismo orbital.
Configuración electrónica
En química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un átomo o atómicamente un producto de orbitales antisimetrizadas.12 La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.
 ORBITAL
ORBITAL
a la resonancia orbital, la relación entre dos órbitas; al módulo orbital, una parte de los cohetes Soyuz; a una maniobra orbital, una maniobra espacial; a una lijadoraorbital, una herramienta portátil.

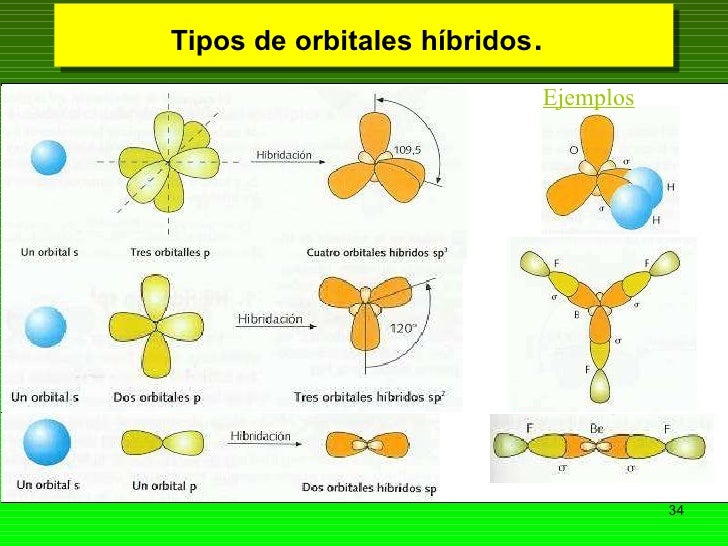
TIPOS DE ORBITAL
Transcripción de Tipos y formas de orbitales
1) Número cuántico principal (n) Describe el tamaño del orbital, sus valores son enteros y positivos (1, 2, 3...) mientras mas grande es el número de "n" mayor es la distancia entre un electrón en el orbital respecto al núcleo. Números cuánticos Para describir la distribución de los electrones hay 3 números cuánticos (derivan de la ecuación de Schrodinger, ya que en su modelo el electrón puede ocupar un espacio tridimensional, necesita tres coordenadas), se utilizan para describir los orbitales atómicos e identificar los electrones que están dentro. El cuarto número cuántico describe el comportamiento de un determinado electrón y completa la descripción de los electrones en los átomos. ORBITAL Descripción ondulatoria del tamaño, forma y orientación de una región del espacio disponible para un electrón 3) Número cuántico magnético (m) Puede tener valores enteros entre l y l, lo que incluye cero. Este número cuántico describe la orientación del orbital en el espacio Orbitales S Orbitales d y f En el subnivel "d" existen cinco orbitales. Y el subnivel "F" posee siete orbitales. TIPOS Y FORMAS DE ORBITALES Cada orbital describe una distribución específica de densidad electrónica en el espacio, dada por su densidad de probabilidad. Por tanto, cada orbital tiene una energía y una forma características. 2) Número cuántico angular ó azimutal (l) Describe la forma del orbital, los valores de "l" dependen del número cuantico principal l=n-1, por ejemplo si n=1 l=0, si n=2 l=0, ó 1, n=3 l=0, 1, 2.
El valor de "l" se designa con las letras s, p, d, f. La secuencia de las letras s, p, d, f tiene un origen histórico, los físicos que estudiaron los espectros de emisión observaron lineas finas (Sharp), otras Difusas, algunas intensas, se refirieron a ellas como Principales. Las letras califican lo estados de energía, después de la letra D va la F para el estado fundamental. Es independiente del ángulo, lo que supone que presenta simetría esférica. Los límites de esta superficie esférica definen la región del espacio para la cual la probabilidad de encontrar al electrón es elevada, generalmente superior al 75% Orbitales P En el subnivel "p" existen tres orbitales que son px, py, pz
El valor de "l" se designa con las letras s, p, d, f. La secuencia de las letras s, p, d, f tiene un origen histórico, los físicos que estudiaron los espectros de emisión observaron lineas finas (Sharp), otras Difusas, algunas intensas, se refirieron a ellas como Principales. Las letras califican lo estados de energía, después de la letra D va la F para el estado fundamental. Es independiente del ángulo, lo que supone que presenta simetría esférica. Los límites de esta superficie esférica definen la región del espacio para la cual la probabilidad de encontrar al electrón es elevada, generalmente superior al 75% Orbitales P En el subnivel "p" existen tres orbitales que son px, py, pz
Los subniveles de energía en el átomo son la forma en la cual los electrones se organizan en las capas electrónicas, su distribución en la molécula o átomo. Estos subniveles de energía son llamados orbitales.
Tabla periódica de los elementos
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a la teoría de la evolución en biología (que sucedió al concepto de la Gran Cadena del Ser), y a las leyes de la termodinámica en la física clásica».2
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.

Un mapa mental es un diagrama usado para representar conceptos o información con palabras sencillas o plasmar ideas, tareas, dibujos, u otros conceptos ligados y dispuestos radicalmente alrededor de una palabra clave o de una idea central.
¿Qué es una mezcla?
¿Qué pasa cuando el agua se mezcla con aceite?, ¿y cuando se mezcla con azúcar? Existen distintos tipos de mezclas y cada uno tiene características específicas. Para que empieces a repasar, en esta nota vas a encontrar información sobre las mezclas y un experimento para que hagas una muy sabrosa.

Mezclas heterogéneas.
Una mezcla heterogénea es aquella que posee una composición no uniforme en la cual se pueden distinguir a simple vista sus componentes, está formada por dos o más sustancias físicamente distintas, distribuidas en forma desigual. Las partes de una mezcla heterogénea pueden separarse fácilmente.
MEZCLAS HOMOGÉNEAS
Las mezclas homogéneas o uniformes son aquellas en las que la composición es la misma en toda la muestra. La mezcla homogénea también se denomina disolución, que consiste en un disolvente, normalmente la sustancia presente en mayor cantidad, y uno o más solutos.

MÉTODOS DE SEPARACIÓN DE MEZCLAS
Imagina que, para realizar un trabajo de clase, has comprado limaduras de hierro y de aluminio. En un descuido se han mezclado, y ahora necesitas separarlas o, de lo contrario, no podrás llevar a cabo tu tarea. ¿Cómo lo harías?
En muchas ocasiones encontramos mezclas homogéneas y heterogéneas cuyos componentes necesitamos separar sin alterar la naturaleza de las sustancias puras. En ambos casos, recurriremos a procedimientos físicos.
Los métodos de separación de componentes de una mezcla más usados son:
7.1.SEPARACIÓN MAGNÉTICA
Habrás pensado que la forma más rápida y efectiva de separar el hierro del aluminio es recurrir a un imán (si no tuvieras ninguno podrías improvisarlo, ya que muchos cierres de bolsos y tapas de carcasas protectoras de móvil son imanes). Puesto que el hierro es atraído por el imán pero el aluminio no, habrás solucionado el problema de una manera sencilla.
El método empleado en este caso para separar los componentes de tu mezcla heterogénea recibe el nombre de separación magnética. Solo puede emplearse si uno de ellos presenta propiedades magnéticas (como el hierro) y el resto no.
7.2.DECANTACIÓN
Se emplea para separar líquidos con densidades diferentes y que no se mezclan entre sí (inmiscibles), como el agua y el aceite. En estos casos, se utiliza un embudo de decantación.
¿Cómo se usa el embudo de decantación?
- Se vierte la mezcla en el embudo de decantación, asegurándonos antes de que la llave de la parte inferior está cerrada (en posición horizontal), para que la mezcla no salga mientras la vertemos.
- Se deja reposar hasta que ambos líquidos se separan bien.
- Se coloca un vaso de precipitados debajo del embudo y se abre la llave. Empezará a salir el líquido más denso (es decir, el que está en la parte inferior de la mezcla).
- Cerramos la llave en cuanto haya pasado todo este primer líquido.
- El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave.
7.3.FILTRACIÓN
Este método se usa para separar un sólido de un líquido en el cual no se disuelve (no es soluble en él), como la arena en suspensión en el agua. Para ello, se hace pasar la mezcla heterogénea a través de un filtro con un tamaño de poro adecuado (menor que el de las partículas que queremos separar). Habitualmente se emplea un papel de filtro acoplado a un embudo.
7.4.DESTILACIÓN
Se utiliza para separar líquidos solubles entre sí que tienen temperaturas de ebullición muy diferentes, como el agua y el alcohol.
¿Cómo se lleva a cabo una destilación?
La mezcla se vierte en un matraz esférico (o de fondo redondo) y se calienta. Cuando se alcanza la temperatura de ebullición más baja de los componentes, este comienza a convertirse en vapor y pasa por el refrigerante, donde se enfriará y condensará. El líquido resultante, llamado destilado, se recoge en un recipiente (un vaso de precipitados, por ejemplo).

7.5.EVAPORACIÓN Y CRISTALIZACIÓN
Se emplea para separar un soluto sólido disuelto en un disolvente líquido, como la sal en el agua. El proceso comienza con la evaporación del disolvente (natural o forzada mediante calefacción) y acaba con la deposición en el fondo del recipiente (generalmente, un cristalizador) del sólido en forma de cristales. Cuanto más lenta sea la evaporación del disolvente, más grandes serán los cristales.

7.6.
 +
+



+





No hay comentarios:
Publicar un comentario